德克萨斯大学西南医学中心的研究人员使用世界上最强大的超级计算机之一进行了复杂的模拟,为研究 SNARE 蛋白质如何导致生物膜融合提供了新的线索。
他们的发现发表在《美国国家科学院院刊》上,提出了这种普遍存在的过程的新机制,并最终可能导致针对膜融合被认为出错的情况的新治疗方法。
“生物学教科书说,圈套将膜聚集在一起以引起融合,许多人对这种解释感到满意。但我不是,因为接触的膜通常不会融合。我们的模拟更深入地展示了这一重要过程是如何发生的,”研究负责人、德克萨斯大学西南医学中心生物物理学、生物化学和药理学教授 Jose Rizo-Rey(“Josep Rizo”)博士说。
膜融合对于生命至关重要。一个典型的例子发生在神经元中,这些细胞构成了神经系统的基础,并构成了大脑、脊髓和周围神经的大部分。这些细胞通过从囊泡中释放一种称为神经递质的化学物质来相互交流,这些化学物质必须从内部与原始神经元的细胞膜融合,以便神经递质被释放并被其他神经元识别。
真核生物(其细胞具有膜结合核的生物体)中的所有细胞膜均由双层磷脂组成,磷脂分子具有与水相互作用的头部和排斥水的尾部。这些分子的头部形成膜的内衬和外衬,尾部夹在中间。磷脂双层膜包围真核细胞、它们的细胞核、许多细胞器以及一些其他特征,例如称为囊泡的充满液体的囊,其在细胞内和细胞之间携带货物。
1990 年左右,研究人员发现 SNARE(可溶性 N-乙基马来酰亚胺敏感因子附着蛋白受体的缩写)在膜融合中发挥着关键作用。人们普遍认为,这些蛋白质形成了一种复合物,其作用就像拉链一样,使膜紧密接触并导致它们融合。然而,里佐-雷伊博士解释说,多年来的研究表明这一理论存在重大漏洞。例如,突变的 SNARE 仍然使膜接触,但不会导致它们融合。
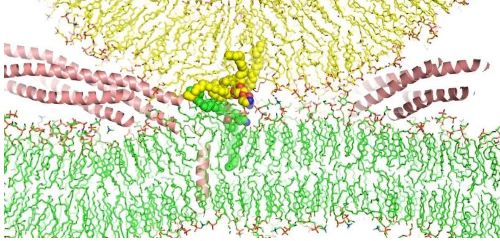
为了更好地了解 SNARE 在膜融合中的作用,Rizo-Rey 博士和他的同事尝试了一种不同的方法。依靠位于德克萨斯大学奥斯汀分校德克萨斯高级计算中心的 Frontera(世界上最快的超级计算机之一),该团队对囊泡与模仿神经元细胞膜的脂质双层融合进行了全原子分子动力学模拟。
这种类型的模拟使用算法根据所涉及原子的属性来预测特定系统的所有分子如何相互作用——在本例中大约有 530 万个原子,这需要巨大的计算能力来跟踪。
该模拟表明,SNARE 复合体不仅仅将生物膜聚集在一起,还诱导细胞膜和囊泡中的磷脂翻转,将其防水尾部混合在一起。这种作用导致膜融合,随后形成一个孔,将囊泡的内容物排出细胞外。
Rizo-Rey 博士警告说,需要进一步的研究来证实这种机制发生在细胞中。然而,他说,从物理化学的角度来看,模拟的结果很有意义,并且与多年来其他几项细胞融合研究的结果非常吻合。
他补充说,尽管这一发现没有直接与健康相关的影响,但研究人员最终可能能够利用这些发现为各种神经系统疾病(例如阿尔茨海默病、帕金森病、精神分裂症和癫痫症)制定新疗法。一些现有的治疗方法已经专注于促进或抑制神经递质的释放。
里佐-雷伊博士说,糖尿病、心脏病、高血压、癌症和病毒感染也高度依赖于膜融合,最终可以通过干预这一过程来治疗。
标签:
免责声明:本文由用户上传,如有侵权请联系删除!
