最近,为了扩大使用 iPS 细胞衍生的巨核细胞制造血小板的规模,江藤浩二教授(临床应用系)及其研究团队通过计算模拟和生物测试,为基于叶轮的生物反应器设计了新的变化,以实现大规模、高质量的血小板生产。这项研究发表在《通信工程》上。
iPS 细胞衍生的可扩增永生化巨核细胞祖细胞系 (imMKCL) 是一种可再生的体外生产大量血小板用于输血的方法。尽管之前已使用 10 升罐系统通过以最佳湍流能量和剪切应力重建湍流生成了 1000 亿 (10 11 ) 个有活力的 iPS 细胞衍生血小板,但真正的工业规模生产对于为血小板减少症和其他血小板疾病患者持续供应可输血血小板是必不可少的。
因此,该团队开始了这项研究,开发了一种 50 升良好生产规范(GMP) 级、一次性美国药典标准 () IV 级聚乙烯罐和一种新型电机调节器,用于更大规模的有效血小板生产。
通过计算流体动力学 (CFD) 分析模拟此类 50 L 罐中产生的湍流能量和剪切应力,研究人员确定了最佳运动速度,以使较大的系统能够模拟之前检查过的较小罐内的情况。值得注意的是,尽管速度经过优化以产生类似的湍流能量和剪切应力作为平均值,但较大的罐的效率始终低于测试的较小罐(3 或 10 L)。
此外,容量更大的50L罐产生的血小板不仅数量少,质量也较差,经透射电子显微镜检查发现超微结构异常。最终,研究小组在体外试验或输注到小鼠体内(止血和循环动力学)评估其功能时,都表现出了较低的性能。
为了从生物学角度探究为何扩大规模后仍无法生产出高质量的血小板,研究团队在不同运动速度下分别于血小板生产第 3 天和第 5 天收集 imMKCL,并进行 RNA 测序分析。主成分分析显示,培养条件显著改变了 imMKCL 基因表达谱。
而在最佳条件下(对应于较小的罐培养),imMKCL 会上调与血管生成、细胞粘附、细胞骨架、缺氧、血小板功能和 TGF-β 信号传导相关的基因,而过速下的 imMKCL 则会上调与炎症和受损线粒体功能相关的基因,这与产生不太健康的血小板相一致。
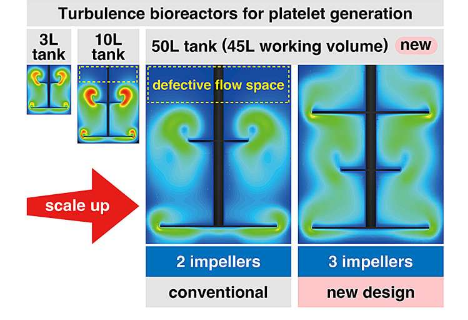
最后,由于很明显扩大规模后的血小板生产条件并不理想,研究团队重新回到了绘图板上,并进行了额外的 CFD 模拟,以确定扩大规模后湍流是否变得不理想。值得注意的是,他们通过这项分析发现,在更大的 50 L罐内,存在相当大的未优化湍流空间。
为了尽量减少这种不必要的空间(非湍流体积),研究团队模拟了三级叶轮系统,发现应该可以减少湍流缺陷体积。然而,这样的系统目前还没有商业化,因此,研究人员开发了一种新的生物反应器系统,以确保细胞和湍流分布更均匀。构建了一个小型的3L系统,该系统表现出预期的高效高质量血小板生产能力。
尽管还需要做更多的工作来构建更大规模的系统并测试新的生物反应器设计,但研究团队预计下次的扩大过程会更加顺利,因为新的设计不存在同样的局限性。
标签:
免责声明:本文由用户上传,如有侵权请联系删除!
